Химическая реакция которая позволяет накормить весь мир
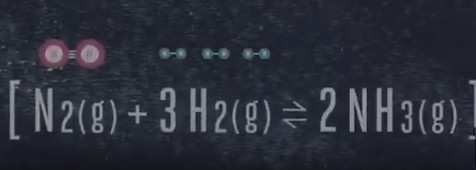
Чтобы вы назвали самым важным открытием, сделанным за последние несколько столетий, компьютер, автомобиль, электричество или открытие атома?
Можно поспорить, что это химическая реакция: [N2 (g) + 3H2 (g) = 2 NH3 (g)
Молекула азота плюс три молекулы водорода дают две молекулы аммиака, это процесс Габера – процесс связывания молекул азота из воздуха с молекулами водорода или по-другому – превращение воздуха в удобрение. Без этой реакции сельхозпроизводители смогли бы обеспечить достаточным количеством еды, лишь 4 миллиарда человек, на текущий момент нас более 7 миллиардов, таким образом без процесса Габера более трех миллиардов людей могли остаться без еды.
Азот в виде нитрата [NO3] является питательным веществом, необходимым для выживания растений. Различные культуры по мере своего роста потребляют азот, удаляя его из почвы. Азот может пополнятся с помощью длительных процессов естественного удобрения, например таких как разлагающиеся трупы животных, но люди хотят выращивать пищу намного быстрее. Теперь приведем печальный факт: в атмосферном воздухе около 78% азота, но растения не могут просто брать азот из воздуха, поскольку он содержит очень сильные тройные связи, которые растения не могут разорвать.
Габер понял, как можно взять азот из воздуха и поместить его в землю.
В 1908 году немецкий химик Фриц Габер разработал химический способ использования огромных запасов азота из воздуха. Ученый нашел метод, который позволяет брать азот из воздуха, связывать его с водородом, формируя аммиак, которые далее может быть введен в почву, где он быстро преобразуется в нитрат.
Нам следует знать кое-что о химическом равновесии, оно может быть достигнуто, когда реакция проходит в закрытой таре. Например, вы помещаете водород и азот в закрытый контейнер, где они начинают взаимодействовать. В самом начале эксперимента азота и водорода очень много и синтез аммиака протекает с большой скоростью, но по мере того, как водород и азот взаимодействуют и расходуются, скорость реакции замедляется, поскольку снижается количество молекул обоих элементов и в конце концов молекулы аммиака достигают точки, в которой они начинают распадаться обратно на азот и водород. Спустя некоторое время обе реакции минус, синтез и распад аммиака – минус достигнут одинаковой скорости, когда эти скорости равны, мы говорим, что реакция достигла равновесия. Это может хорошо звучать, только не в том случае, если мы хотим произвести тонну аммиака. Габер хотел, чтобы аммиак вообще не распадался, но если вы просто дадите реакции протекать в закрытой таре, вот что произойдет: и здесь пришел на помощь французский химик Henry Le Chatellier, он обнаружил, что если взять равновесную систему и добавить к ней что-то, скажем азот, то система будет стремиться вернуться в равновесное состояние снова, ученый также обнаружил, что если увеличить давление на систему, то она будет пытаться вернуть давление на прежний уровень. Это можно сравнить с переполненной комнатой, чем больше молекул, тем выше давление. Если мы еще раз посмотрим наше уравнение [N2 (g) + 3H2 (g) = 2 NH3 (g)
То увидим, что с левой стороны есть 4 молекулы, а с правой только 2. Таким образом. Если мы хотим, чтобы в комнате стало свободнее и как следствие этого давление снизилось, то система должна начать синтезировать азот и водород, синтезируя более компактные молекулы аммиака. Габер понял, что для того, чтобы производить в большом количестве аммиак, нужно создать устройство, которое бы непрерывно добавляло азот и водород одновременно с этим увеличивая давление на равновесную систему, именно это он и сделал.
На сегодняшний день аммиак – важнейший продукт химической промышленности по всему миру, примерно 131 миллион тонн производится каждый год, 80 % этого продукта применяется для производства удобрений, остальной аммиак используется в промышленных и бытовых моющих средств и других соединениях азота, таких как азотная кислота. Последние исследования показали, что половина азота из этих удобрений не усваивается растениями, в следствие этого азот находится в виде летучего химического соединения в водных ресурсах и атмосфере земли, нанося ущерб окружающей среде.
Конечно Габер не предвидел данной проблемы, когда сделал свое открытие, но современные ученые работают над его новаторской концепцией, чтобы создать процесс Габера 21 века, который будет приносить такую же пользу, без опасных последствий.
Агротрейд Клуб - оперативна галузева інформація для Вашого бізнесу!